10月開始!醫療器械“實名制”全國執行,影響所有人
確定!2019年10月1日全國開始執行,目前第一批116家試點械企、第一批108家試點醫院、第一批近100個醫械編碼產品清單已公布(文末附三份詳單)。
一文讀懂醫療器械編碼與唯一標識規則。
實名制,持證上崗
還記得2010年的春運么?廣鐵集團、成都鐵路局開始試行火車票實名制。同樣,眾所期待的醫療器械“實名制”也正式來了。
實名制是核查的真實身份的一種制度,它有利于行業主管部門進行監督,有利于個人身的確認等諸多好處,對于醫療器械領域這個益處不言而喻。
根據國家藥監局發布《醫療器械唯一標識系統規則》中要求,在我國境內銷售、使用的醫療器械,其唯一標識系統都應當符合本規則,從2019年10月1日起施行。

(截圖來源:國家藥監局官網)
規則與分類這樣規定
藥監局消息指出,此規則是根據《醫療器械監督管理條例》制定而成的,管轄的范圍是在中華人民共和國境內銷售、使用的醫療器械,其唯一標識系統應當符合本規則。
醫療器械唯一標識系統由3部分組成,分別是醫療器械唯一標識、唯一標識數據載體和唯一標識數據庫。具體來看:
醫療器械唯一標識:是指在醫療器械產品或者包裝上附載的,由數字、字母或者符號組成的代碼,用于對醫療器械進行唯一性識別。
醫療器械唯一標識數據載體:是指存儲或者傳輸醫療器械唯一標識的數據媒介。
醫療器械唯一標識數據庫:是指儲存醫療器械唯一標識的產品標識與關聯信息的數據庫。
需要注意的是,醫療器械唯一標識包括產品標識和生產標識兩項。具體來看:
產品標識:為識別注冊人/備案人、醫療器械型號規格和包裝的唯一代碼;
生產標識:由醫療器械生產過程相關信息的代碼組成,根據監管和實際應用需求,可包含醫療器械序列號、生產批號、生產日期、失效日期等。
在影響上,產品發生可能影響醫療器械識別、追溯的變更或者監管要求變化時,應當創建新的產品標識。
醫療器械停止銷售、使用的,其產品標識不得用于其他醫療器械;重新銷售、使用時,可使用原產品標識。
企業這樣做才合規
根據《規則》,注冊人/備案人負責按照本規則創建和維護醫療器械唯一標識,在產品或者包裝上賦予醫療器械唯一標識數據載體,上傳相關數據,利用醫療器械唯一標識加強產品全過程管理。
鼓勵醫療器械生產經營企業和使用單位積極應用醫療器械唯一標識進行相關管理。
當產品發生可能影響醫療器械識別、追溯的變更或者監管要求變化時,應當創建新的產品標識。
醫療器械停止銷售、使用的,其產品標識不得用于其他醫療器械;重新銷售、使用時,可使用原產品標識。
同時,《規則》顯示,醫療器械唯一標識編制標準應當符合國家藥品監督管理局以及符合本規則要求的發碼機構制定的相關標準。注冊人/備案人應當按照醫療器械唯一標識的編制標準創建、維護醫療器械唯一標識。
注冊人/備案人應當選擇與其創建的醫療器械唯一標識相適應的數據載體標準,對以其名義上市的醫療器械最小銷售單元和更高級別的包裝或者醫療器械產品上賦予唯一標識數據載體,并確保在醫療器械經營使用期間唯一標識數據載體牢固、清晰、可讀。
注冊人/備案人應當按照相關標準或者規范要求上傳、維護和更新唯一標識數據庫中的相關數據,并對數據的真實性、準確性、完整性負責。
注冊人/備案人應當在申請醫療器械注冊、注冊變更或者辦理備案時,在注冊/備案管理系統中提交其產品標識。
注冊人/備案人應當在產品上市銷售前,將產品標識和相關數據上傳至醫療器械唯一標識數據庫。
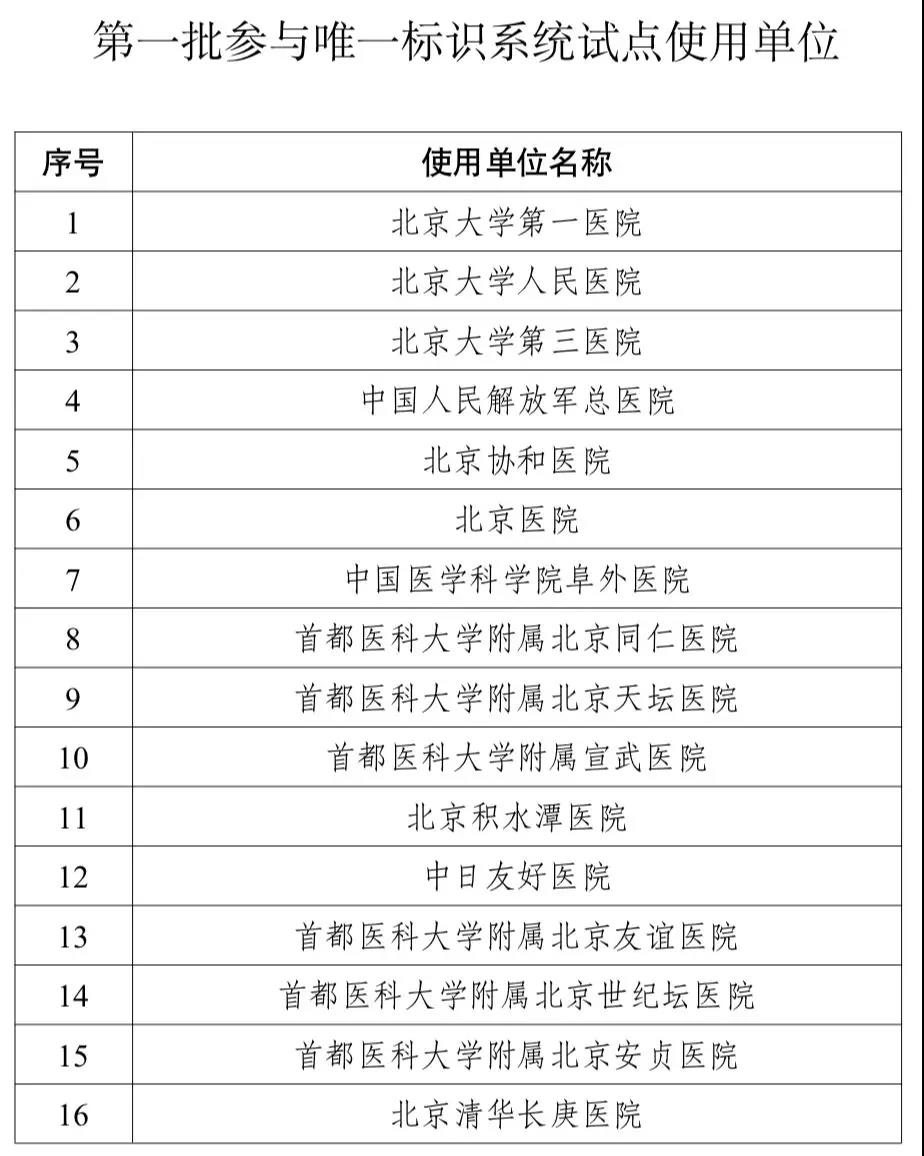
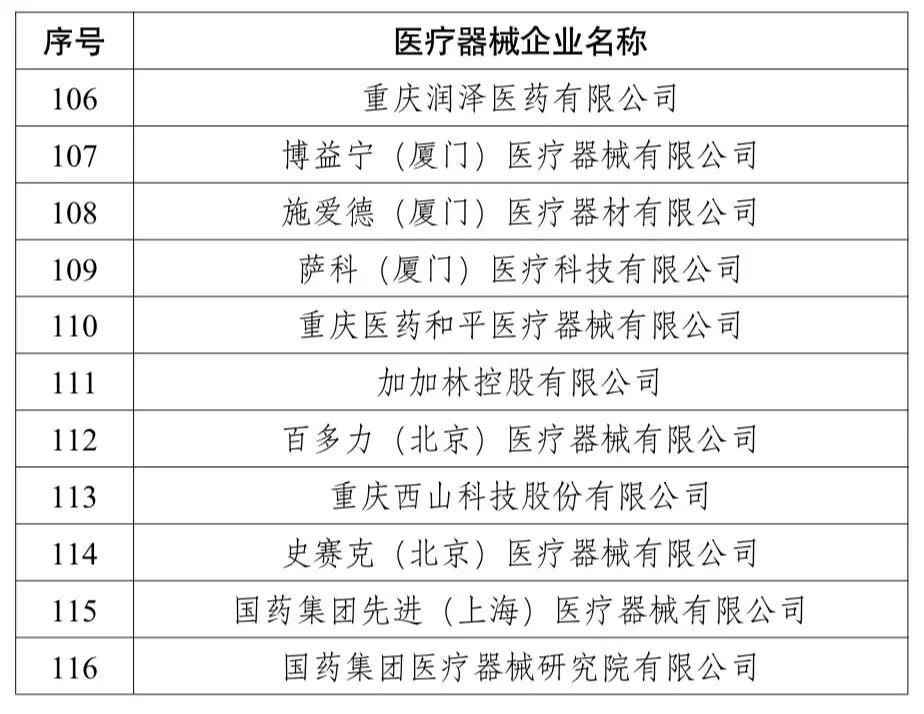
這些多家醫院和企業試水
近期,據國家藥監局官網消息,醫療器械唯一標識系統試點工作步入實質階段。國家藥品監管局副局長徐景和指出,建立UDI制度,強化源頭賦碼,實現從源頭生產到臨床使用全鏈條醫療器械通查通識。
唯一標識的推行不僅有助于提高企業信息化管理水平,實現醫療器械供應鏈的透明化、可視化、智能化,還可構建醫療器械監管大數據。
同時,可實現對醫療器械來源可查、去向可追、責任可究,推動智慧監管,對提升監管效能和社會治理能力有重要意義。
那么,究竟什么是UDI,UDI是英文Unique Device Identification的縮寫,直譯過來是唯一的器械身份標識,是對醫療器械在其整個生命周期賦予的身份標識,是在產品供應鏈中的唯一“身份證”。
目前,多家醫療器械的企業已在試水。共有116企業,不乏美敦力、史賽克等行業巨頭。與此同時,第一批試點的108家醫療機構名單也已公布。(文末附詳單)
耗材同樣有碼有證
醫用耗材因編碼難度大一直備受醫療界關注。
耗材不同于藥品的是,耗材不僅數量龐雜且種類繁多,同一產品在不同地區招標采購時的名稱不同,各地關于耗材的政策規定多種多樣,給耗材招標采購以及支付等環節帶來諸多不便。
基于此,行業的規范發展亟需醫用耗材編碼標準的出現。
國家醫保局近期公布的《醫保疾病診斷和手術操作、藥品、醫療服務項目、醫用耗材四項信息業務編碼規則和方法》,對醫保醫用耗材編碼做了展示:
醫保醫用耗材編碼分5個部分共20位,通過大寫英文字母和阿拉伯數字按特定順序排列表示。其中第1部分是耗材標識碼,第2部分是分類碼,第3部分是通用名碼,第4部分是產品特征碼,第5部分是生產企業碼。規則如下:
第一部分為1個字母:耗材標識碼,用1位大寫英文字母“C”表示。
第二部分為6個數字:分類碼,根據醫用耗材學科、用途、部位、功能劃分;
第三部分為3個數字:通用名碼,創建全國統一的醫保醫用耗材通用名碼;
第四部分為5個數字:產品特征碼,根據耗材材質、規格等特征賦予的代碼;
第五部分為5個數字:生產企業碼,依據醫療器械注冊證或備案憑證為耗材生產企業賦予的唯一代碼。

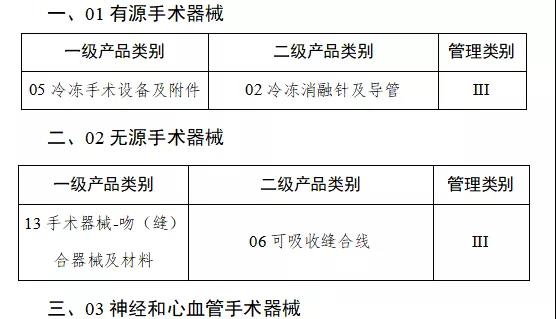
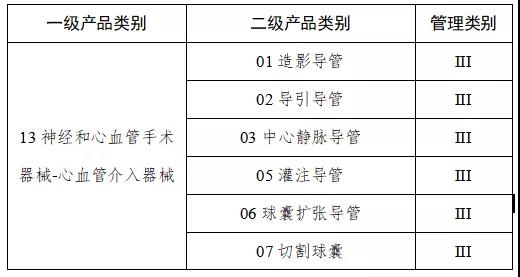
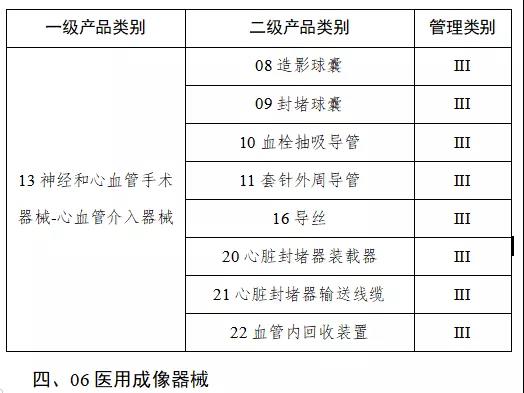
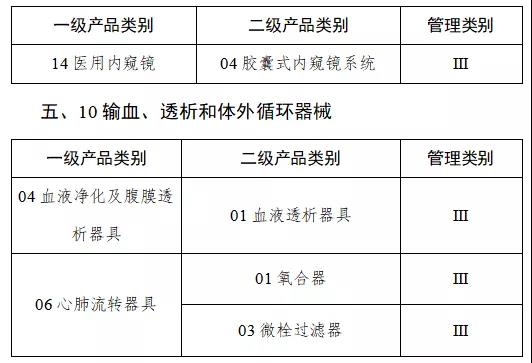
第一批產品目錄確定
9月中旬,國家藥監局發布《關于做好第一批實施醫療器械唯一標識工作有關事項的通告(征求意見稿)》。按照要求將分步推行醫療器械唯一標識制度。
通知指出,按照風險程度和監管需要,確定部分有源植入類、無源植入類等高風險第三類醫療器械作為第一批醫療器械唯一標識實施品種。
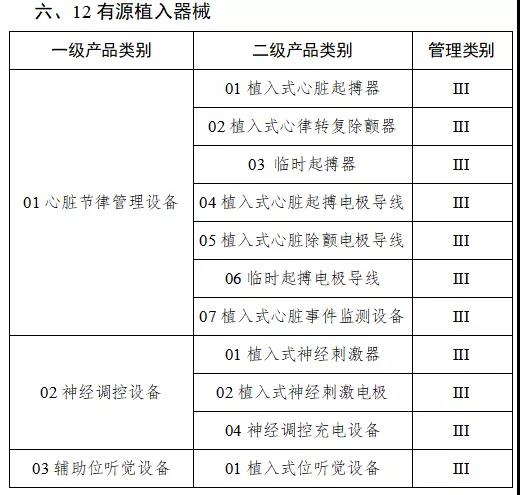
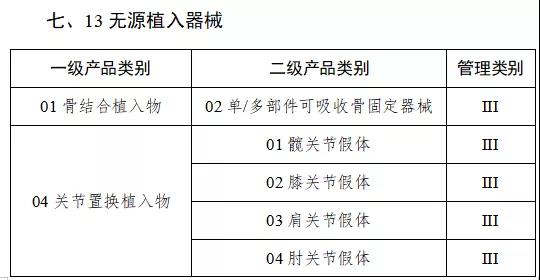


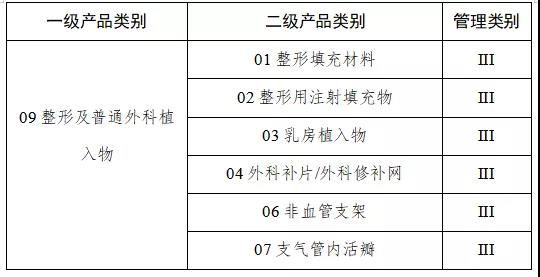
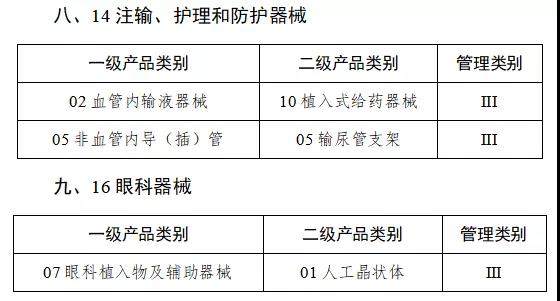










來源:賽柏藍器械



